Hubungan Konfigurasi Elektron, Elektron Valensi, Periode dan Golongan dalam Tabel Periodik Unsur
- Get link
- X
- Other Apps
Pada tahun 1913, pakar fisika Denmark, Niels Henrik David Bohr mengajukan model atom yang dikenal dengan nama model atom bohr. Model atom tersebut yakni:
□ Elektron-elektron dalam atom hanya dapat melintasi lintasan-lintasan tertentu yang disebut kulit-kulit atau tingkat-tingkat energi, yaitu lintasan dimana elektron berada pada keadaan stationer, artinya tidak memancarkan energi.
□ Kedudukan elektron dalam kulit-kulit, tingkat-tingkat energi dapat disamakan dengan kedudukan seseorang yang berada pada anak-anak tangga. Seseorang hanya dapat berada pada anak tangga pertama, kedua, ketiga, dan seterusnya, tetapi ia tidak mungkin berada di antara anak tangga-anak tangga tersebut.
Model atom Niels Bohr dapat dianalogikan seperti sistem tata surya mini. Pada sistem tata surya, planet-planet beredar mengelilingi matahari. Dalam atom, proton diibaratkan sebagai matahari dan elektron diibaratkan sebagai planet-planet, namun bedanya kalau pada sistem tata surya setiap lintasan (orbit) hanya dihuni 1 planet sedangkan pada atom setiap lintasan dapat dihuni lebih dari 1 elektron. Dalam model atom bohr dikenal dengan istilah konfigurasi elektron. Lalu apa yang dimaksud dengan konfigurasi elektron itu?
Pengertian Konfigurasi Elektron
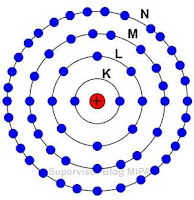
Konfigurasi elektron adalah susunan elektron dalam setiap lintasan atau kulit atom. Kulit atom terdiri atas kulit pertama, kedua, ketiga, keempat yang masing-masing kulit disebut kulit K, L, M, N dan seterusnya. Selain kulit, elektron-elektron pada atom juga bisa menempati lintasan subkulit, yaitu subkulit s, p, d, f dan seterusnya. Susunan atom disetiap kulit maupun subkulit memiliki aturan yang berbeda-beda.
Pengertian Elektron Valensi
Elektron valensi adalah jumlah elektron yang terdapat pada kulit terluar dari suatu atom yaitu kulit yang paling jauh dari inti atom. Untuk bisa mengetahui elektron valensi suatu atom, kita harus mengetahui konfigurasi elektron dari suatu atom terlebih dahulu. Lalu bagaimana caranya menentukan konfigurasi elektron dan elektron valensi suatu unsur?
Cara Menentukan Konfigurasi Elektron dan Elektron Valensi
Terdapat dua cara penentuan konfigurasi elektron, yaitu:
1. Cara per kulit (cara K L M N)
Cara ini hanya berlaku untuk menuliskan konfigurasi elektron pada atom-atom unsur golongan utam (golongan A).
2. Cara per subkulit (cara s p d f)
Cara per subkulit selain dapat digunakan untuk untuk menuliskan konfigurasi elektron pada unsur golongan utama juga dapat digunakan untuk menuliskan konfigurasi unsur golongan transisi (golongan B).
Dari dua cara di atas dalam artikel ini hanya akan menjelaskan cara menuliskan konfigurasi elektron dengsn cara per kulit saja, untuk cara per subkulit akan dibahas di artikel berikutnya.
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa aturan yang harus selalu diingat, yaitu:
a.
|
Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3 (kulit M), kulit ke-4 (kulit N), dan seterusnya.
| ||||
b.
|
Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah:
| ||||
2n2
| |||||
Dengan n = nomor kulit
| |||||
Kulit K dapat menampung maksimal 2 elektron
| |||||
Kulit L dapat menampung maksimal 8 elektron
| |||||
Kulit M dapat menampung maksimal 18 elektron
| |||||
Kulit N dapat menampung maksimal 32 elektron dan seterusnya.
| |||||
c.
|
Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron.
| ||||
Contoh konfigurasi elektron beberapa unsur:
3Li
|
- Kulit K maksimum 2 elektron
- Kulit N diisi sisa elektron yaitu 1 elektron
- Jadi konfigurasi elektron 3Li → 2, 1
- Dan elektron valensi dari 3Li adalah 1
| |
20Ca
|
- Kulit K maksimum 2 elektron
- Kulit L maksimum 8 elektron
| |
Jumlah elektron sisa = 20 – (2 + 8) = 10
| ||
- Kulit M diisi 8 elektron
| ||
Karena jumlah elektron sisa 10 sementara jumlah maksimum elektron di kulit M adalah 18, maka kulit M diisi dengan jumlah maksimum elektron di kulit L sebanyak 8 elektron
| ||
- Kulit N diisi sisa elektron yaitu 2 elektron
- Jadi konfigurasi elektron 20Ca → 2, 8, 8, 2
- Dan elektron valensi dari 20Ca adalah 2
| ||
56Ba
|
- Kulit K maksimum 2 elektron
- Kulit L maksimum 8 elektron
- Kulit M maksimum 18 elektron
| |
Jumlah elektron sisa = 56 – (2 + 8 + 18) = 28
| ||
- Kulit N diisi 18 elektron
| ||
Karena jumlah elektron sisa 28 sementara jumlah maksimum elektron di kulit N adalah 32, maka kulit M diisi dengan jumlah maksimum elektron di kulit M sebanyak 18 elektron
| ||
Sekarang elektron sisa = 56 – (2 + 8 + 18 + 18) = 10
| ||
-Kulit O diisi 8 elektron
| ||
Karena jumlah maksimum elektron di kulit O adalah 50 elektron sedangkan elektron sisa 10, maka kulit O diisi dengan jumlah elektron maksimum di kulit L yaitu 8 elektron
| ||
- Kulit P diisi sisa elektron yaitu 2 elektron
- Jadi konfigurasi elektron 56Ba → 2, 8, 18, 18, 8, 2
- Dan elektron valensi dari 56Ba adalah 2
|
Berikut ini adalah contoh konfigurasi elektron beberapa unsur golongan utama
Unsur
|
Nomor Atom
|
Konfigurasi Elektron pada Kulit
|
Elektron Valensi
| |||
K
|
L
|
M
|
N
| |||
Helium
|
2
|
2
|
2
| |||
Nitrogen
|
7
|
2
|
5
|
5
| ||
Oksigen
|
8
|
2
|
6
|
6
| ||
Kalsium
|
20
|
2
|
8
|
8
|
2
|
2
|
Bromin
|
35
|
2
|
8
|
18
|
7
|
7
|
Konfigurasi Elektron pada Ion
Kita tahu bahwa ion adalah atom yang bermuatan listrik. Jika bermuatan positif disebut ion positif atau kation sedangkan atom yang bermuatan negatif disebut ion negatif atau anion. Ion positif terbentuk apabila atom melepas elektron sedangkan ion negatif terbentuk apabila atom menyerap elektron. Berarti dalam hal ini ada penambahan atau pengurangan jumlah elektron.
Untuk memahami konfigurasi pada ion positif dan negatif, perhatikan tabel berikut ini
Tabel Konfigurasi Elektron Ion Positif (Kation)
Lambang
Atom |
Konfigurasi
Elektron |
Jumlah
Elektron Lepas |
Setelah Melepaskan
Elektron |
Jumlah
Muatan |
Lambang
Ion |
Konfigurasi
Elektron Ion | |
Jumlah
Proton (+) |
Jumlah
Elektron (-) | ||||||
3Li
|
2, 1
|
1
|
3
|
2
|
+1
|
Li+
|
2
|
11Na
|
2, 8, 1
|
1
|
11
|
10
|
+1
|
Na+
|
2, 8
|
20Ca
|
2, 8, 8, 2
|
2
|
20
|
18
|
+2
|
Ca2+
|
2, 8, 8
|
Li, Na dan Ca melepaskan elektron, jumlah protonnya akan lebih banyak daripada elektron maka muatan Li, Na dan Ca jadi positif. Konfigurasi elektron ionnya ditulis dengan mengurangi elektron yang dilepaskannya.
Tabel Konfigurasi Elektron Ion Negatif (Anion)
Lambang
Atom |
Konfigurasi
Elektron |
Jumlah
Elektron Lepas |
Setelah Melepaskan
Elektron |
Jumlah
Muatan |
Lambang
Ion |
Konfigurasi
Elektron Ion | |
Jumlah
Proton (+) |
Jumlah
Elektron (-) | ||||||
8O
|
2, 6
|
2
|
8
|
10
|
-2
|
O2-
|
2, 8
|
9F
|
2, 7
|
1
|
9
|
10
|
-1
|
F-
|
2, 8
|
17Cl
|
2, 8, 7
|
1
|
17
|
18
|
-1
|
Cl-
|
2, 8, 8
|
O, F dan Cl menerima elektron, jumlah elektron akan lebih banyak daripada proton maka muatan O, F dan Cl jadi negatif. Konfigurasi elektron ionnya ditulis dengan menambah elektron yang diterimanya.
Jika kalian sudah tahu mengenai konfigurasi elektron dan elektron valensi, lalu pertanyaannya sekarang adalah apa hubunganya antara sistem konfigurasi elektron dengan periode dan golongan unsur dalam Sistem Periodik Unsur (SPU) modern?
Hubungan Sistem Konfigurasi Elektron dengan Letak Unsur dalam Tabel Periodik Unsur
Untuk mengetahui hubungan antara konfigurasi elektron dengan letak unsur dalam SPU, perhatikan 2 tabel konfigurasi elektron berikut ini.
Tabel Konfigurasi Elektron Unsur Golongan IA
Periode
|
Unsur
|
Z
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
1
|
Hidrogen
|
1
|
1
| ||||||
2
|
Litium
|
3
|
2
|
1
| |||||
3
|
Natrium
|
11
|
2
|
8
|
1
| ||||
4
|
Kalium
|
19
|
2
|
8
|
8
|
1
| |||
5
|
Rubidium
|
37
|
2
|
8
|
18
|
8
|
1
| ||
6
|
Sesium
|
55
|
2
|
8
|
18
|
18
|
8
|
1
| |
7
|
Fransium
|
87
|
2
|
8
|
18
|
32
|
18
|
8
|
1
|
Tabel Konfigurasi Elektron Unsur Periode 2
Periode
|
Unsur
|
Z
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
1
|
Litium
|
3
|
2
|
1
| |||||
2
|
Berilium
|
4
|
2
|
2
| |||||
3
|
Boron
|
5
|
2
|
3
| |||||
4
|
Karbon
|
6
|
2
|
4
| |||||
5
|
Nitrogen
|
7
|
2
|
5
| |||||
6
|
Oksigen
|
8
|
2
|
6
| |||||
7
|
Fluor
|
9
|
2
|
7
| |||||
8
|
Neon
|
10
|
2
|
8
|
Berdasarkan konfigurasi elektron unsur-unsur tersebut dapat ditarik hubungan antara konfigurasi elektron dengan letak unsur (nomor golongan dan periode) dalam tabel periodik sebagai berikut:
1.
|
Jumlah elektron valensi
|
: nomor golongan
|
2.
|
Jumlah kulit elektron
|
: nomor periode
|
Pengecualian untuk unsur helium, elektron valensinya 2 tetapi terletak pada golongan gas mulia (VIIIA).
- Get link
- X
- Other Apps






Comments
Post a Comment
Mohon berkomentar secara bijak dengan bahasa yang sopan dan tidak keluar dari topik permasalahan dalam artikel ini. Dan jangan ikut sertakan link promosi dalam bentuk apapun.
Terimakasih.