Perkembangan Tabel Periodik Unsur dari Sistem Klasik Hingga Modern
- Get link
- X
- Other Apps
Setelah para ahli secara terus-menerus menemukan unsur-unsur baru, maka jumlah unsur semakin banyak dan hal ini akan menimbulkan kesulitan dalam mempelajarinya, jika tidak ada cara yang praktis untuk mempelajarinya. Oleh karena itu, para ahli berusaha membuat pengelompokan sehingga unsur-unsur tersebut tertata dengan baik.
Puncak dari usaha tersebut adalah terciptanya suatu tabel unsur yang disebut sistem periodik unsur. Sistem periodik unsur ini mengandung banyak sekali informasi tentang sifat-sifat unsur, sehingga sangat membantu dalam mempelajari unsur-unsur yang kini berjumlah tidak kurang dari 118, yang meliputi unsur alam dan unsur sintetis.
Pengertian Sistem Periodik Unsur
Sistem Periodik Unsur adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat unsur-unsurmya.
Perkembangan Tabel Periodik Unsur
Perkembangan sistem periodik unsur terbagi dalam 3 periode, yaitu sistem pengelompokkan unsur kimia berdasarkan kemiripan sifat zat, massa atom dan berdasarkan nomor atom.
1. Pengelompokkan Unsur Kimia Berdasarkan Kemiripan Sifat Zat
A. Tabel Periodik Klasik
Pada awalnya, unsur-unsur dipelajari secara terpisah-pisah. Ketika jumlah unsur yang ditemukan cukup banyak, akan menyulitkan para ilmuwan untuk mempelajarinya. Ahli-ahli kimia dari Arab dan Persia mulai mengelompokkan unsur berdasarkan sifar kelogamannya.
Sehingga pada masa ini, unsur kimia dikelompokkan kedalam dua jenis, yaitu unsur logam dan nonlogam. Berikut ini adalah tabel sifat-sifat fisika logam dan non logam yang menjadi dasar pengelompokkan unsur kimia.
No.
|
Sifat Fisika Logam
|
Sifat Fisika Nonlogam
|
1
|
Mengilap
|
Tidak mengilap
|
2
|
Pada suhu kamar umumnya
berwujud padat |
Pada suhu kamar dapat
berwujud padat, cair, dan gas |
3
|
Mudah ditempa/dibentuk
|
Sulit dibentuk dan rapuh
|
4
|
Penghantar panas dan listrik
yang baik |
Bukan penghantar panas dan listrik
yang baik |
B. Tabel Periodik Lavoisier
Pada tahun 1789, seoarang ahli kimia dari Prancis Antoine Lavoisier yang juga dikenal sebagai Bapak Kimia Modern, mempublikasikan bukunya yang berjudul Traite Elementaire de Chimie.
Dalam buku tersebut, Lavoisier mengelompokkan 33 unsur kimia (pada masa itu jumlah unsur kimia yang sudah ditemukan baru 33 unsur) ke dalam 4 kelompok berdasarkan sifat kimianya, yaitu kelompok gas, nonlogam, logam, dan tanah.
Berikut ini adalah Tabel Sistem Periodik Unsur menurut Lavoisier
Kelompok
|
Unsur
|
Gas
|
Cahaya, kalor, oksigen, azote (nitrogen)
dan hidrogen |
Nonlogam
|
Sulfur, fosfor, karbon, radikal muriatik (asam klorida),
radikal florin (asam florida), dan radikal boracid (asam borak) |
Logam
|
Antimon, perak, arsenik, bismuth, kobalt, tembaga, timah, besi,
mangan, raksa, molibdenum, nikel, emas, platina, timbal, tungsten, dan seng. |
Tanah
|
Kapur, magnesia (magnesium oksida), barit (barium oksida),
alumina (aluminium oksida), dan silika (silikon oksida). |
2. Pengelompokkan Unsur Kimia Berdasarkan Massa Atom
A. Tabel Periodik Triade Dobereiner
Pada tahun 1829, Johan Wolfgang Dobereiner melihat adanya kemiripan sifat di antara beberapa unsur, lalu mengelompokkannya menurut kemiripan sifat yang ada. Ternyata tiap kelompok terdiri atas tiga unsur, sehingga disebut Triade.
Jika unsur-unsur dalam satu triade tersebut disusun menurut kenaikan massa atom-atomnya, ternyata massa atom maupun sifat-sifat unsur yang kedua merupakan rata-rata dari massa atom unsur pertama dan ketiga. Penemuan ini memperlihatkan adanya hubungan antara massa atom dengan sifat-sifat unsur.
Contoh:
Triade
|
Ar unsur yang di tengah
| |||||||
Cl
|
Br
|
I
|
Ar C + Ar I
|
=
|
35,5 + 127
|
=
|
81,25
| |
gas
|
cair
|
padat
|
2
|
2
| ||||
Berikut ini adalah tabel periodik unsur menurut Dobereiner
Triade 1
|
Triade 2
|
Triade 3
|
Triade 4
|
Triade 5
|
Li
|
Ca
|
S
|
Cl
|
Mn
|
Na
|
Sr
|
Se
|
Br
|
Cr
|
K
|
Ba
|
Te
|
I
|
Fe
|
Sistem Triade ini ternyata memiliki kelemahan yaitu kurang efisien karena ternyata ada beberapa unsur lain yang tidak termasuk dalam satu triade tetapi memiliki sifat-sifat mirip dengan triade tersebut.
B. Tabel Periodik Oktaf Newland
Pada tahun 1864, John Alexander Reina Newland mengumumkan penemuannya yang disebut Hukum Oktaf. Unsur-unsur tersebut disusun berdasarkan kenaikan massa atom relatifnya.
Menurut Newland, unsut-unsur yang berselisih 1 oktaf (unsur nomor 1 dengan 8, unsur nomor 2 dengan 9, dst.) menunjukkan kemiripan sifat. Kecenderungan tersebut dinyatakan sebagai Hukum Oktaf Newland, yaitu
Jika unsur-unsur disusun berdasarkan kenaikan massa atom maka sifat unsur tersebut akan berulang setelah unsur kedelapan. Berikut ini adalah tabel periodik unsur menurut Newland
Do
1
|
Re
2
|
Mi
3
|
Fa
4
|
Sol
5
|
La
6
|
Si
7
|
H
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Na
|
Mg
|
Al
|
Al
|
P
|
S
|
Cl
|
K
|
Ca
|
Cr
|
Cr
|
Mn
|
Fe
|
Co, Ni
|
Cu
|
Zn
|
Y
|
Y
|
As
|
Se
|
Br
|
Rb
|
Sr
|
Ce, La
|
Ce, La
|
Di, Mo
|
Ro, Ru
|
Pd
|
Ag
|
Cd
|
U
|
U
|
Sb
|
I
|
Te
|
Cs
|
Ba, V
|
Ta
|
Ta
|
Nb
|
Au
|
Pt, Ir
|
Os
|
Hg
|
Ti
|
Tl
|
Bi
|
Th
|
Tabel periodik unsur Newland ini tidak dapat digunakan untuk semua jenis unsur karena memiliki kelemahan, yaitu hukum oktaf hanya sesuai untuk unsur yang massa atomnya kecil, sedangkan untuk unsur dengan massa atom besar ketika disusun tidak terjadi pengulangan sifat sesuai hukum oktaf.
C. Tabel Periodik Mendeleev
Pada tahun 1869, ilmuwan Rusia, Dmitri Ivanovic Mendeleev berdasarkan pengamatannya terhadap 63 unsur yang sudah dikenal saat itu, menyimpulkan bahwa sifat-sifat unsur adalah fungsi periodik dari massa atom relatifnya. Hal itu berarti jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, sifat-sifat tertentu akan berulang secara periodik.
Dalam mengelompokkan unsur-unsur, Mendeleeev lebih menekankan pada persamaan sifat unsur dibandingkan dengan kenaikan massa atom relatifnya, sehingga terdapat tempat-tempat kosong dalam tabel periodik tersebut. Tempat-tempat kosong ini yang kemudian diramalkan akan diisi unsur-unsur yang waktu itu belum ditemukan. Di kemudian hari ramalan itu terbukti dengan ditemukannya unsur-unsur yang mempunyai sifat-sifat yang mirip sesuai ramalannya. Berikut ini adalah tabel periodik unsur menurut Mendeleev
Periode
|
Gol. I
–
R2O
|
Gol. II
–
RO
|
Gol. III –
R2O4
|
Gol. IV
R4
RO2
|
Gol. V
RH4
R2O4
|
Gol. VI
RH2
RO4
|
Gol. VII
RH
R2O7
|
Gol. VIII
RH
R2O7
|
1
|
H=1
| |||||||
2
|
Li=7
|
Be=9,2
|
B=11
|
C=12
|
N=14
|
O=16
|
F=19
| |
3
|
Na=23
|
Mg=24
|
Al=27,3
|
Si=28
|
P=31
|
S=32
|
Cl=35,5
| |
4
|
K=39
|
Ca=40
|
…. =44
|
Ti=48
|
V=51
|
Cr=52
|
Mn=55
|
Fe = 56,
Co = 59, Ni = 59, Cu = 63 |
5
|
(Cu=63)
|
Zn=65
|
…..=68
|
….=72
|
As=75
|
Se=78
|
Br=80
| |
6
|
Rb=85
|
Sr=87
|
Yt=88
|
Zr=90
|
Nb=94
|
Mo=96
|
….=100
|
Ru = 104,
Rh = 104, Pd = 106, Ag = 108 |
7
|
(Ag=108)
|
Cd= 112
|
In=113
|
Sn=118
|
Sb=122
|
Te=125
|
I=127
| |
8
|
Cs=133
|
Ba=137
|
Di=138
|
……
|
…….
|
…….
|
…….
| |
9
|
……
|
……
|
…..
|
……
|
…….
|
…….
|
…….
| |
10
|
……
|
……
|
Er=178
|
La=180
|
Ta=182
|
W=184
|
…….
|
Os = 195,
Ir = 197, Pt = 198, Au = 199 |
11
|
(Au=199)
|
Hg=200
|
Tl =204
|
Pb=207
|
Bi=208
|
…….
|
…….
| |
12
|
……
|
…….
|
……
|
Th=231
|
…….
|
U=240
|
…….
|
Beberapa hal penting yang terdapat dalam sistem periodik mendeleev antara lain sebagai berikut:
■ Dua unsur yang berdekatan, massa atom relatifnya mempunyai selisih paling kurang dua atau satu satuan.
■ Terdapat kotak kosong untuk unsur yang belum ditemukan, seperti 44, 68, 72, dan 100.
■ Dapat meramalkan sifat unsur yang belum dikenal seperti ekasilikon; d. dapat mengoreksi kesalahan pengukuran massa atom relatif beberapa unsur, contohnya Cr = 52,0 bukan 43,3.
Kelebihan Tabel Periodik Mendeleev adalah sebagai berikut:
■ Sifat kimia dan fisika unsur dalam satu golongan mirip dan berubah secara teratur.
■ Valensi tertinggi suatu unsur sama dengan nomor golongannya.
■ Dapat meramalkan sifat unsur yang belum ditemukan pada saat itu dan telah mempunyai tempat yang kosong.
Kelemahan Tabel Periodik Mendeleev sebagai berikut.
■ Panjang periode tidak sama dan sebabnya tidak dijelaskan.
■ Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, contoh Te (128) sebelum I (127).
■ Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat.
■ Valensi unsur yang lebih dari satu sulit diramalkan dari golongannya.
■ Anomali (penyimpangan) unsur hidrogen dari unsur yang lain tidak dijelaskan.
D. Tabel Periodik Meyer
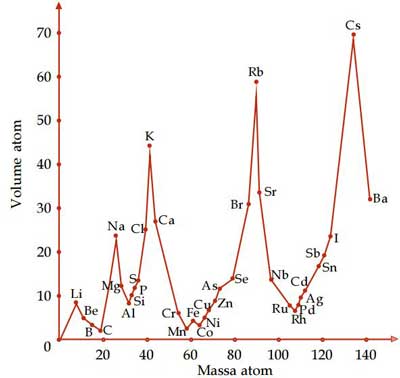
Hampir mirip dengan sistem periodik yang dikemukakan Mendeleev, Lothar Meyer mengusulkan sistem periodik berdasarkan massa atom. Menurut Meyer, volume atom suatu unsur yang diplotkan dengan massa atom tersebut akan membentuk grafik yang berperiodik secara teratur. Perhatikan grafik antara volume atom dan massa atom berikut.
Berdasarkan grafik tersebut terlihat bahwa unsur-unsur yang sifatnya mirip membentuk suatu keteraturan. Misalnya, unsur logam alkali, yaitu Na, K, dan Rb, berada di puncak. Kemudian, Meyer mengembangkan penemuannya ke dalam bentuk tabel seperti berikut.
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
-
|
B = 11,0
|
Al = 27,3
|
-
|
-
|
-
|
In = 113,4
|
Tl = 202,7
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
C = 11,97
|
Si = 28
|
-
|
-
|
-
|
Sn = 117,8
|
-
|
Pb = 206,4
|
-
|
-
|
-
|
Ti = 48
|
-
|
Zr = 89,7
|
-
|
-
|
-
|
-
|
N = 14,01
|
P = 30,9
|
-
|
As = 74,9
|
-
|
Sb = 122,1
|
-
|
Bi = 207,5
|
-
|
-
|
-
|
V = 51,2
|
-
|
Nb = 93,7
|
-
|
Ta = 182,2
|
-
|
-
|
O = 15,96
|
-
|
-
|
Se = 78
|
-
|
Te = 128
|
-
|
-
|
-
|
-
|
-
|
Cr = 52,4
|
-
|
Mo = 95,6
|
-
|
W = 183,5
|
-
|
-
|
F = 19,1
|
Cl = 35,38
|
-
|
Br = 79,75
|
-
|
J = 126,5
|
-
|
-
|
-
|
-
|
-
|
Mn = 54,8
|
-
|
Ru = 103,5
|
-
|
Os = 198,6
|
-
|
-
|
-
|
-
|
Fe = 55,9
|
-
|
Rh = 104,1
|
-
|
Ir = 196,7
|
-
|
-
|
-
|
-
|
Co = Ni = 58,6
|
-
|
Pd = 106,2
|
-
|
Pt = 196, 7
|
-
|
Li = 7,01
|
Na = 22,99
|
K = 39,04
|
-
|
Rb = 85,2
|
-
|
Cs = 132,7
|
-
|
-
|
-
|
-
|
-
|
Cu = 63,3
|
-
|
Ag = 107,66
|
-
|
Au = 196,2
|
-
|
Be = 9,3
|
Mg = 23,9
|
Ca = 39,9
|
-
|
Sr = 87,0
|
-
|
Ba = 136,8
|
-
|
-
|
-
|
-
|
Zn = 64,9
|
-
|
Cd = 111,6
|
-
|
Hg = 199,
|
-
|
3. Pengelompokkan Unsur Kimia Berdasarkan Nomor Atom
A. Tabel Periodik Moseley
Pada 1911, Ernest Rutherford berhasil menemukan salah satu partikel dasar penyusun atom, yaitu proton. Dua tahun kemudian, Henry Moseley meneliti hubungan antara sifat suatu atom dan jumlah protonnya (nomor atom) menggunakan spektroskopi sinar-X.
Moseley memplotkan frekuensi sinar-X dan kenaikan nomor atom. Kemudian, beliau menyusun unsur-unsur tersebut dalam bentuk tabel periodik sebagai berikut.
Group O
|
I
a b
|
II
a b
|
III
a b
|
IV
a b
|
V
a b
|
VI
a b
|
VII
a b
|
VIII
a b
|
H 1
| ||||||||
He 2
|
Li 3
|
Be 4
|
B 5
| |||||
Ne 10
|
Na 11
|
C 6
|
N 7
|
O 8
|
F 9
| |||
Mg 12
|
Al 13
| |||||||
Ar 18
|
K 19
|
Si 14
|
P 15
|
S 16
|
Cl 17
| |||
Cu 29
|
Ca 20
|
Sc 21
| ||||||
Kr 36
|
Rb 37
|
Zn 30
|
Ga 31
|
Ti 22
|
V 23
|
Cr 24
|
Mn 25
|
Fe 26,
Co 27, Ni 28 |
Ag 47
|
Sr 38
|
Y 39
|
Ge 32
|
As 33
|
Se 34
|
Br 35
| ||
Xe 54
|
Cs 55
|
Cd 48
|
In 49
|
Zr 40
|
Nb 41
|
Mo 42
|
-
|
Ru 44,
Rh 45, Pd 46 |
Au 79
|
Ba 56
|
57–71*
|
Sn 50
|
Sb 51
|
Te 52
|
I 53
| ||
Rn 66
|
--
|
Hg 80
|
Tl 81
|
Hf 72
|
Ta 73
|
W 74
|
Re 75
|
Os 76,
Ir 77, Pt 78 |
Ra 88
|
Ac 89
|
Pb 82
|
Bi 83
|
Po 84
|
-
| |||
Th 90
|
Pa 91
|
U 92
|
Tabel periodik Moseley berhasil memperbaiki kelemahan tabel periodik Mendeleev. Dalam tabel periodik Mendeleev, penempatan telurium (massa atom 128) dan iodin (nomor atom 127) tidak sesuai dengan kenaikan massa atomnya. Namun, berdasarkan tabel periodik Moseley, penempatan unsur Te dan I sesuai dengan kenaikan nomor atomnya.
B. Tabel Periodik Modern
Tabel periodik unsur yang digunakan sekarang yaitu Tabel Periodik Unsur Modern. Setelah tabel periodik unsur Mendeleev, pada tahun 1915 Henry Moseley menemukan nomor atom dan menyusun unsur-unsur dalam tabel periodik berdasarkan kenaikan nomor atom.
Beberapa penelitian menunjukkan adanya hubungan antara nomor atom dengan sifat-sifat unsur, maka tabel periodik Mendeleev perlu penyempurnaan. Pada tabel periodik unsur modern unsur disusun dalam golongan dan periode.
Ada dua sistem yang digunakan pada penomoran golongan yaitu sistem Amerika dan sistem IUPAC. Sistem Amerika menggunakan angka Romawi I sampai VIII, masing-masing terdiri dari golongan A dan B. Sistem IUPAC (International Union Pure and Applied Chemistry) menggunakan angka Arab 1 sampai dengan 18.
Oleh karena sistem penomoran golongan IUPAC belum memasyarakat di kalangan ahli kimia, maka penggolongan sistem Amerika lebih banyak digunakan, begitu juga di Indonesia. Tabel periodik unsur modern digambarkan sebagai berikut.
- Get link
- X
- Other Apps



Comments
Post a Comment
Mohon berkomentar secara bijak dengan bahasa yang sopan dan tidak keluar dari topik permasalahan dalam artikel ini. Dan jangan ikut sertakan link promosi dalam bentuk apapun.
Terimakasih.